背景
宾夕法尼亚大学的研究人员开发了一种新的靶向方法,以防止基因疗法治疗神经系统疾病后在背根神经节的感觉神经元中看到的毒性。这是要清除的重要障碍,因为该领域致力于为脊柱肌肉萎缩等疾病患者提供更安全有效的基因疗法。
使用腺相关病毒(AAV)载体的基因治疗已显示出治疗神经系统疾病的有希望的结果。但是,对非人类灵长类动物(NHPs)的研究表明,针对中枢神经系统的基因疗法可能会在背根神经节(DRGs)中引起毒性,从而导致共济失调。现在,Hordeaux等人利用了几乎仅存在于DRG中的microRNA的优势,并证明消除DRG中转基因表达的特异性降低了基因治疗介导的NHP毒性。该处理不影响其他细胞群体中转基因的转导。结果表明,该方法对于限制与CNS基因治疗相关的DRG毒性可能有用。这种新方法可以普遍提高基因治疗的安全性。该发现本周在线发表在《Sci. Transl. Med.》上。
结果
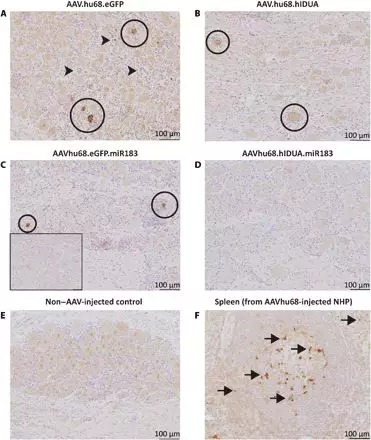
经由血液或脑脊髓液将腺相关病毒(AAV)载体递送至非人类灵长类动物(NHP)的中枢神经系统与背根神经节(DRG)毒性相关。常规的免疫抑制方案不能阻止这种毒性,可能是因为它可能是由高转导率引起的,而高转导率又可能由于靶细胞中转基因产物的过量而引起细胞应激。为了验证这一假设并开发出消除DRG毒性的方法,研究人员利用了microRNA(miR)183复合物的内源性表达(主要局限于DRG神经元)来特异性下调这些细胞中的转基因表达。他们将miR183的序列靶标导入相应转基因信使RNA 3'非翻译区的载体基因组中,并将载体注射到NHP的大脑中。未经修饰的AAV载体的给药导致靶组织的强力转导和DRG神经元的毒性。与免疫系统活性不介导这种神经元毒性的提议相一致,研究人员发现类固醇给药在缓解这种病理方面无效。但是,在载体中包含miR183靶标可减少DRG神经元的转基因表达和毒性,而不会影响灵长类动物大脑其他部位的转导。这种方法可能有助于减少DRG毒性和相关的发病率,并应促进许多中枢神经系统疾病的基于AAV的基因疗法的发展。
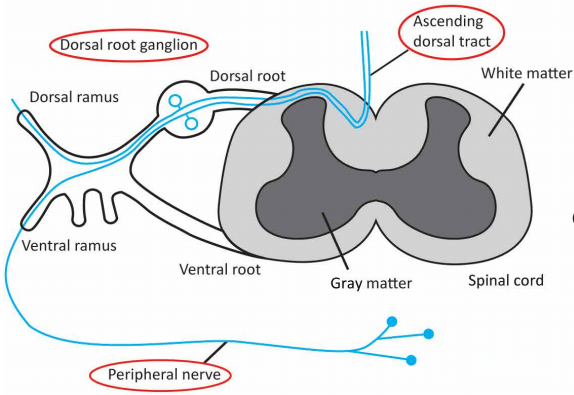
论文ID
原名:MicroRNA-mediated inhibition of transgene expression reduces dorsal root ganglion toxicity by AAV vectors in primates
译名:MicroRNA介导的转基因表达抑制可降低灵长类动物中AAV载体对背根神经节的毒性。
期刊:Science Translational Medicine.
IF: 16.304
发表时间:2020.11.11
发表单位:宾夕法尼亚大学
原文链接:https://stm.sciencemag.org/content/12/569/eaba9188

内容
静脉内施用大剂量的AAV靶向中枢神经系统(CNS)或肌肉骨骼系统后,会发生最严重的毒性反应,在某些情况下会演变成致命的出血和休克综合症。在大多数高剂量AAV临床试验中均观察到肝酶急性升高和/或血小板减少。尽管罕见,但严重的毒性反应以贫血,肾衰竭和补体激活为特征。
在这项研究中,研究人员表征了NAVs中AAV载体诱导的DRG毒性。基于他们的假设,即DRG毒性是由转基因mRNA和/或蛋白质的高细胞内表达的过表达相关应激引起的,研
为了纠正这一点,他们用microRNA靶标修饰了转基因,该靶标旨在降低DRG中转基因的表达水平。研究人员报告说,这种改变消除了80%以上的转基因表达,并降低了灵长类动物的毒性。
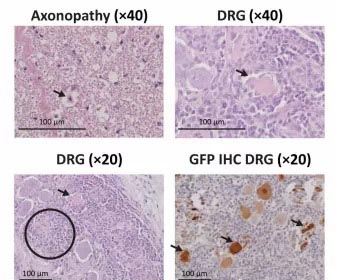
这是改善AAV治疗中枢神经系统安全性的一种安全,直接的方法。该方法可用于设计其他基因治疗载体,从而在受毒性影响的细胞类型中抑制转基因表达,而对其他类型则不起作用,这是至关重要的。
宾夕法尼亚大学的研究人员记录了DRG在非人类灵长类动物中的毒性后,他们开始设计一种克服它的方法。尽管其在灵长类动物中无症状,但在仔细研究中枢神经系统组织病理学后,其损害变得明显。研究人员知道,对人类DRG的损害可能导致负责将神经冲动传递至大脑的轴突降解。四肢麻木和无力等副作用也随之而来。
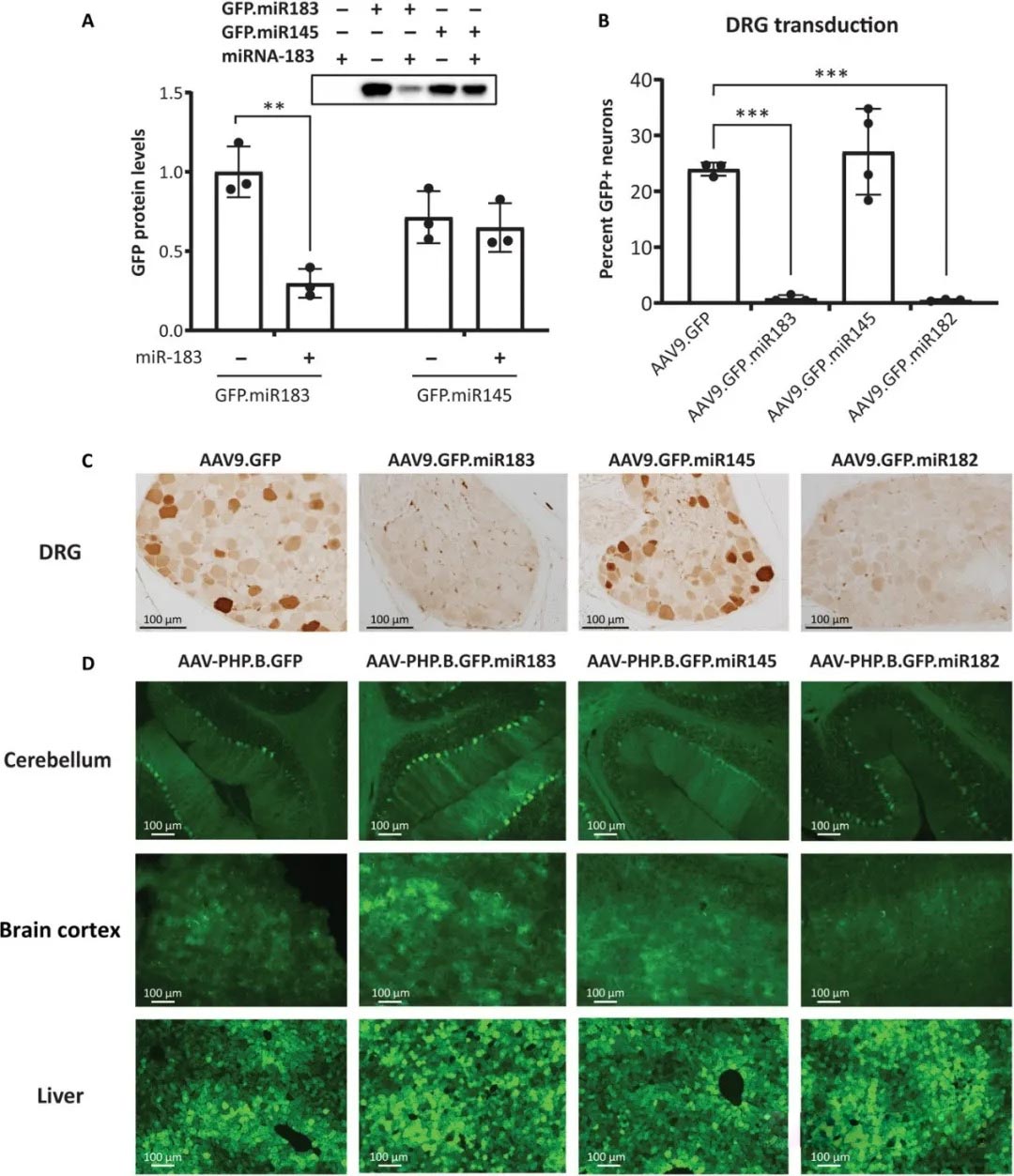
在这项新研究中,研究人员首先在小鼠中然后在灵长类动物中注射了带有和不带有microRNA靶标的载体。microRNA调节基因表达,并成为细胞中理想的靶标。之所以选择microRNA-183是因为它在很大程度上局限于DRG中的神经元。
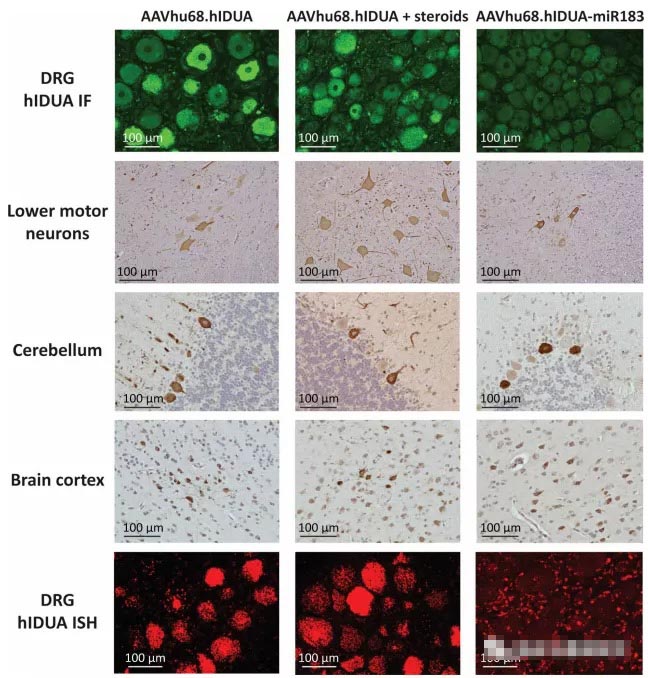
使用未经修饰的AAV载体可导致将新基因稳固地递送到靶组织中,并对DRG神经元产生毒性。另一方面,长达90天后对标本进行的组织学分析显示,带有miRNA靶标的载体可显着降低转基因表达以及DRG神经元的毒性,而不会影响灵长类动物大脑其他部位的转导。首先认为是免疫反应引起毒性。然而,研究人员通过实验证明了这一假说,该实验表明免疫抑制剂和类固醇在减轻毒性方面是不成功的。
作者说:“我们担心在我们大多数NHP研究中观察到的DRG病理。”这种修饰的载体显示出降低DRG毒性的巨大希望,并应促进针对许多中枢神经系统疾病的更安全的基于AAV的基因疗法的开发。”
总结
本文主要介绍:这种减少DRG毒性的方法可用于考虑用于CNS指导基因治疗的任何AAV载体。载体中的miR183靶标可能会将miR183分子转移到其正常靶标之外,从而可能扰乱细胞的生理功能。证据表明毒性仅限于表达miR183(DRG)的大量转导细胞。研究人员尚未观察到用含AAV miR183靶标的载体治疗的NHP的毒性。如完整簇相对于单个miRNA敲除模型所建议的那样,具有miR183、182和96共同靶点的miR183簇的冗余可以降低这一理论风险。此外,已知表达miR183的其他细胞类型(嗅觉上皮,视网膜,内耳和激活的免疫细胞)在ICM或全身AAV递送后将无法有效地转导。考虑到监管机构对DRG毒性提出的关注,他们认为将miRNA183脱靶策略纳入CNS基因治疗计划是审慎的做法。该策略的主要局限性在于减轻诸如夏科特-玛丽齿(Charcot-Marie-Tooth)等神经元形式的疾病中的DRG毒性,在该疾病中,DRG转导对于实现治疗效果必不可少。
总之,研究人员已经开发出一种减轻NAV中AAV引起的DRG毒性的方法。可以在各种治疗应用中的各种AAV载体上测试该方法。













